
مفاهیم اصلی
در این مقاله با عدد اتمی، تعریف آن، کاربرد آن در دسته بندی عناصر و تاریخچه آن به عنوان یک نظریه در شیمی آشنا خواهید شد.
موضوعات تحت پوشش در مقالات دیگر
- نحوه خواندن جدول تناوبی
- ایزوتوپ چیست؟
- واکنش های هسته ای
- متعادل کردن معادلات شیمیایی
- جی جی تامپسون و لوله اشعه کاتدی
- جیمز چادویک و نوترون
المانها
دقیقاً چه چیزی یک عنصر را از دیگری متمایز می کند؟ چرا کربن و هیدروژن و اکسیژن را مواد متفاوتی می دانند؟ به طور خاص به چه چیزی می توانیم اشاره کنیم که تفاوت بین این عناصر را در ابتدایی ترین سطح آن توضیح دهد؟
جواب عدد اتمی است. اگر به جدول تناوبی نگاه کنید، متوجه می شوید که هر عنصر یک مقدار منحصر به فرد بین 1 تا 118 دارد که شیمیدانان آن را “عدد اتمی” می نامند. هیدروژن دارای عدد اتمی 1. کربن دارای عدد اتمی 6. اکسیژن دارای عدد اتمی 8 است.

در اولین رژگونه، ممکن است فرض کنید که عدد اتمی یک عنصر دلخواه است. از آنجایی که هیچ شکافی در اعداد اتمی از 1 تا 118 وجود ندارد، به راحتی می توان فرض کرد که عدد اتمی تنها به عنوان یک شناسایی عددی مناسب عمل می کند. حتی ممکن است به مزایای سازماندهی داده ای فکر کنید که چنین شناسایی های عددی ارائه می کنند. با این حال، عدد اتمی دلخواه نیست. چیزی اساسی در مورد ساختار زیراتمی هر عنصر می گوید .
عدد اتمی چیست؟
در اصل عنصر نوعی اتم است. اتم ها خود ساختارهای گرد کوچکی هستند که از آنچه شیمیدانان ذرات زیراتمی می نامند، یعنی پروتون، الکترون و نوترون تشکیل شده اند. عناصر مختلف شامل اتم هایی با تعداد متفاوتی از این ذرات زیراتمی هستند .
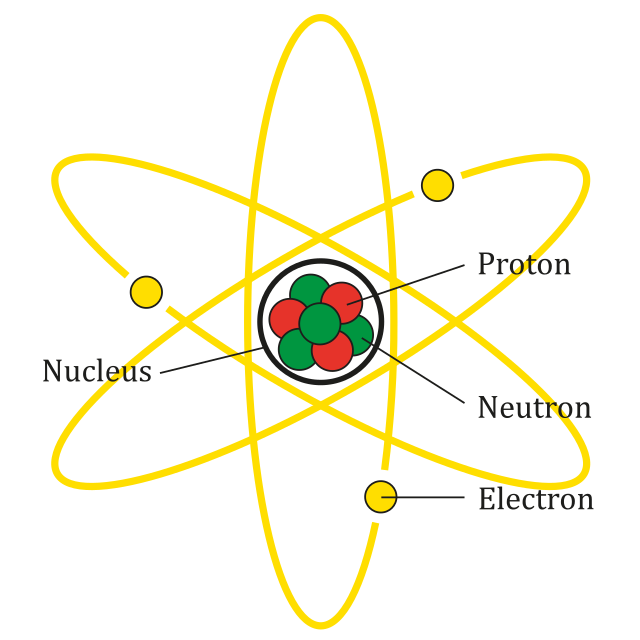
با در نظر گرفتن این موضوع، عدد اتمی یک عنصر نشان دهنده تعداد پروتون های موجود در یک اتم عنصر است. بنابراین، اتم های هیدروژن دارای 1 پروتون، اتم های کربن دارای 6 پروتون و غیره هستند.
نکته مهم این است که شیمیدانان از عدد اتمی به عنوان مشخصه تعیین کننده یک عنصر استفاده می کنند . یک اتم می تواند هر تعداد نوترون و الکترون داشته باشد، اما تا زمانی که 6 پروتون داشته باشد، شیمیدانان همیشه آن را اتم کربن می دانند.
با توجه به کربن خاص، ساختار اتمی آن اغلب دارای 6 نوترون است، اگرچه شیمیدانان در مورد اشکال دیگر کربن با 7، 8 یا بیشتر نوترون می دانند. انواع یک عنصر با اعداد نوترونی متفاوت و بنابراین وزنهای اتمی متفاوت، « ایزوتوپ » عنصر نامیده میشوند. همچنین، اکسیژن در شکل عنصری خود دارای 8 الکترون است، اما در شرایط خاص می تواند 10 الکترون نیز داشته باشد. انواع یک عنصر با اعداد الکترونی متفاوت و در نتیجه بارهای الکتریکی متفاوت، “یون” یک عنصر نامیده می شود.
عدد اتمی و جدول تناوبی
از آنجایی که می دانیم اتم ها نه تنها از نظر تعداد پروتون، بلکه از نظر تعداد نوترون و الکترون نیز می توانند متفاوت باشند، چرا اینقدر به پروتون ها اهمیت می دهیم؟ از این گذشته، شیمیدانان عناصر را بر اساس عدد اتمی در جدول تناوبی سازماندهی می کنند، که نشان دهنده اهمیت ذاتی مربوط به عدد پروتون اتم است. پاسخ در شیمی عناصر مختلف نهفته است.
در حقیقت، شیمیدانان همیشه از اعداد اتمی برای دسته بندی عناصر استفاده نمی کردند. دیمیتری مندلیف، معمار جدول تناوبی مدرن ، اولین جدول خود را در سال 1869 بر اساس جرم اتمی ترتیب داد . از آنجایی که جرم اتمی اساساً برابر با مجموع پروتون ها و نوترون ها است، به شدت با عدد اتمی همبستگی دارد. در واقع، اولین جدول تناوبی مندلیف عناصر را به ترتیبی مشابه جدول مدرن مرتب می کند.

چه چیزی از وزن اتمی استفاده نمی کند؟
با این حال، برخی از مشاهدات سریع جدول نشان داد که ترتیب دادن عناصر بر اساس جرم اتمی مفید و گمراه کننده نبود. اول اینکه برخی از عناصر جرم اتمی منحصر به فردی ندارند. در زمان فرمولاسیون جدول، شیمیدانان جرم اتمی نیکل و کبالت را تقریباً برابر یکدیگر تخمین زدند. تودههای اتمی غیر منحصر به فرد نشان میدهند که نظم دادن معنیدار عناصر به این روش غیرممکن است.
دوم، و نگرانکنندهتر، رفتار شیمیایی عناصر نظمدهی مبتنی بر انبوه را تضعیف کرد. شیمیدانان در آن زمان دریافتند که عناصر خاصی با جرم اتمی بسیار دور دارای ویژگی های شیمیایی مشابهی هستند. فلوئور ، کلر ، برم و ید هر کدام دارای اشکال عنصری دو اتمی بودند ، و همچنین تمایل زیادی به یونیزه شدن منحصراً به بار -1 داشتند. سدیم ، پتاسیم ، روبیدیم و سزیم حالتهای خنثی فوقالعاده ناپایداری داشتند و به نظر میرسید که فقط یونهای باردار +1 را تشکیل میدهند. شیمیدانان همچنین کربن، سیلیکون و سلنیوم و همچنین نیتروژن و فسفر را گروه بندی کردند.و آرسنیک برای رفتار مشابه آنها.
این ترتیب اولین گروه، به نام ” هالوژن ” بود که باعث افزایش ابروهای شیمیدان ها شد. مندلیف جدول را طوری تنظیم کرده بود که این گروه های شیمیایی مشابه یک ردیف مشترک داشته باشند، از جمله ردیفی برای این هالوژن ها. با این حال، او می دانست که تلوریم رفتار شیمیایی مشابهی با عناصر گروه اکسیژن دارد. تلوریم وزن اتمی سنگینتری نسبت به ید دارد، که مندلیف را مجبور کرد آن را یک فاصله قبل از ید قرار دهد تا گروهبندیهای شیمیایی را حفظ کند.
اندکی پس از انتشار اولین جدول مندلیف، مشخص شد که جدول نیاز به بازآرایی دارد.
قدرت عدد اتمی
برای بیش از نیم قرن، شیمیدانان در فضایی نامناسب در مورد جدول تناوبی زندگی می کردند. از یک طرف، آنها فهمیدند که جدول 1869 مندلیف دارای نقص هایی است که یک مدل جدید را ضروری می کند. از سوی دیگر، هیچ مدل بهتری وجود نداشت و جدول جرم اتمی همچنان اکثر گروهبندیهای شیمیایی را حفظ میکرد.
این در سال 1911 زمانی که ارنست رادرفورد داده های آزمایش معروف خود را با ورق طلا منتشر کرد تغییر کرد . رادرفورد این نظریه را مطرح کرد که هر اتم دارای هسته ای از ذرات باردار درون ابری از ذرات با بار مخالف است. مهمتر از همه، این بدان معنی است که دانشمندان می توانند این بار هسته ای را به صورت نظری اندازه گیری کنند. شیمیدانان همچنین نظریه دادند که مقدار بار یک عنصر معین با تعداد ذرات به نام پروتون در هسته مطابقت دارد. در دهههای بعدی، هر بار هستهای که «عدد اتمی» نامیده میشود، اندازهگیری میشد و روشی جایگزین برای ترتیب دادن عناصر ارائه میداد.
بنابراین، شکل مدرن جدول تناوبی فرموله شد. برخلاف جدول قبلی، ترتیب بر اساس عدد اتمی آرایش گروه های شیمیایی را بهتر حفظ می کند.

علاوه بر این، این تکرار مدرن امکان ظهور روندها را در کل جدول فراهم می کند . این روندها عبارتند از الکترونگاتیوی , میل ترکیبی الکترون , شعاع اتمی و انرژی یونیزاسیون . هر روند با تعداد پروتون های هر عنصر رابطه مستقیم دارد. این منجر به افزایش یا کاهش شدت هر روند در هنگام نزدیک شدن به گوشه بالا سمت راست یا پایین سمت چپ جدول می شود. برای مشاهده این روندها، جدول تناوبی تعاملی ما را بررسی کنید .