فشار بخار
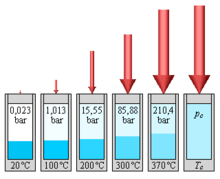
ج: متان در دمای 160- درجه سانتیگراد در 1 بار می جوشد.
ب: در 100- درجه سانتیگراد، متان فشار بخار 25 بار ایجاد می کند.
C: در دمای 170- درجه سانتیگراد (تقریباً هنگامی که توسط نیتروژن مایع خنک می شود )، متان در 1 بار کاملاً مایع می شود.
فشار بخار است فشاری که وقتی یک سیستم بسته بخار در با فاز مایع مرتبط در تعادل ترمودینامیکی قرار می گیرد، ایجاد می شود . فشار بخار با افزایش دما افزایش می یابد و به ماده یا مخلوط موجود بستگی دارد. در یک سیستم باز اگر فشار بخار یک مایع برابر با فشار محیط باشد، مایع شروع به جوشیدن می کند .

فهرست مطالب
توضیح
در یک مایع در دمای بالاتر از صفر مطلق ، ذرات سعی می کنند مایع را ترک کنند. این با کشش سطحی و فشار خارجی وارد بر مایع خنثی می شود. کشش سطحی با افزایش دما کاهش می یابد و باعث افزایش فشار بخار می شود. در نقطه بحرانی کشش سطحی صفر و فشار بخار برابر با فشار بحرانی است.
تعاریف
مواد می توانند در سه حالت کلاسیک تجمع رخ دهند : جامد، مایع و گاز. اگر ماده ای در فاز می گویند گازی و مایع به طور همزمان وجود داشته باشد، فاز گازی را بخار . بنابراین فشار بخار فشار در یک سیستم چند فازی است.
در یک سیستم بسته، تعادل بین فاز مایع و گاز برقرار می شود. فشار جزئی یک جزء را فشار بخار می نامند. برای تاکید بر اینکه تعادل به طور کامل برقرار شده است، از اصطلاح فشار بخار اشباع نیز استفاده می شود.
اگر فاز مایع وجود نداشته باشد، بلکه فقط یک فاز گازی باشد، بحث فشار بخار نیست، بلکه فشار جزئی است – در مورد تنها یک جزء در فاز گاز، این برابر با فشار گاز است .
اگر در سیستم مورد نظر مواد مختلفی وجود داشته باشد، فشار اندازه گیری شده فاز گاز از فشار جزئی مواد مختلف تشکیل می شود. شرط این است که این گازها مانند گازهای ایده آل رفتار کنند ( قانون دالتون ).
تعریف از نظر فیزیک
در فیزیک و شیمی، فشار بخار، فشار جزئی یک گاز (سیستم چند جزئی) را توصیف می کند که با فاز قابل محاسبه است مایع یا جامد خود در تعادل ترمودینامیکی قرار دارد و با استفاده از قانون رائول . در سیستم تک جزیی این فشار را فشار تعادلی می نامند.
تعریف از نظر هواشناسی
در هواشناسی، فشار بخار به معنای فشار جزئی گاز (در اینجا معمولاً فشار بخار آب ) است. نامیده می شود ، که مشابه تعریف فشار بخار در شیمی است حداکثر فشار بخاری که در حالت اشباع وجود دارد، فشار بخار اشباع .
فشار بخار آب
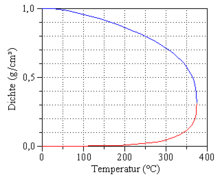

اگر آب و بخار آب در تعادل ترمودینامیکی همزیستی داشته باشند، فشار تابعی از دما است:
- پ = پ س ( تی )
این فشار وابسته به دما و فشار خاص ماده را فشار بخار و نمودار این تابع را منحنی فشار بخار می نامند. منحنی فشار بخار در نقطه بحرانی به پایان می رسد.
با افزایش دما، فشار بخار و چگالی بخار به شدت افزایش می یابد، در حالی که چگالی مایع کاهش می یابد. خواص آب و بخار با افزایش دما بیشتر و بیشتر شبیه می شود، تا اینکه در نقطه بحرانی در T = T c = 373.946 درجه سانتیگراد و p = pc = 22.064 MPa تفاوت به طور کامل ناپدید می شود و تنها یک فاز وجود دارد. با نزدیک شدن به نقطه بحرانی، آنتالپی تبخیر ناپدید می شود و نوسانات چگالی قوی ظاهر می شود که به عنوان مادی بحرانی قابل تشخیص است .
اهمیت عملی
آب گرم شده در یک قابلمه باز زمانی به جوش می آید که فشار بخار آن از فشار هوای محیط بیشتر شود. بنابراین دمای جوش آب بستگی به فشار هوا دارد و با افزایش ارتفاع کاهش مییابد، زیرا فشار هوای طبیعی روی زمین با افزایش فاصله از سطح دریا کاهش مییابد. آب در 93 درجه سانتی گراد در ارتفاع 2000 متری و در دمای 74 درجه سانتی گراد در ارتفاع 8000 متری می جوشد.
قوانین فیزیکی فشار و تبخیر بخار (منحنی فشار بخار، معادله کلازیوس-کلاپیرون و غیره) ابتدا در ارتباط با موتور بخار مورد مطالعه و فرمول بندی قرار گرفتند. در اینجا هم همزیستی مایع و گاز وجود دارد. موتور بخار از این واقعیت استفاده می کرد که فشار بخار مستقل از حجم است تا زمانی که فرد در سیستم دو فاز “مایع-گاز” حرکت کند. تنها چیزی که در دمای ثابت تغییر می کند نسبت “مایع به گاز” است. فشار در دیگ که پیستون را حرکت می دهد در نتیجه حرکت پیستون تغییر نمی کند (حرکت پیستون → تغییر حجم در سیلندر). با این حال، موقعیت پیستون نباید آنقدر تغییر کند که یکی از فازها ناپدید شود.
محاسبه
فشار بخار اشباع را می توان به عنوان مثال با استفاده از روش های لی-کسلر و آمبروز-والتون محاسبه کرد . هر دو روش بر اساس اصل تطابق داده های بحرانی و عامل غیرمرکز با استفاده از است.
معادلات فشار بخار، که از پارامترهای خاص ماده سازگار با دادههای تجربی، مانند معادلات واگنر و آنتوان استفاده میکنند، الزامات دقت بالاتری را برآورده میکنند .
فشار بخار آب در هواشناسی
در هواشناسی، اصطلاح فشار بخار معمولاً به معنای فشار بخار بخار آب (فشار بخار آب) و در نتیجه فشار جزئی آن است. چگالی بخار با رطوبت مطلق مطابقت دارد .
فشار بخار همانطور که توسط هواشناسی تعریف می شود، یعنی فشار جزئی یک گاز در یک مخلوط گاز، می تواند تقریباً با تنظیم مجدد معادله گاز کلی با استفاده از فرمول زیر محاسبه شود:
- ه = r من ⋅ آر من ⋅ تی .
فردی نمادهای فرمول زیر را نشان می دهند مقادیر :
- e – فشار بخار
- ρ i – چگالی بخار ( رطوبت مطلق)،
- Ri – ، ثابت گاز منفرد (برای بخار آب: 461.5 J/(kg K))
- T – دمای مطلق
در دمای هوای 20 درجه سانتیگراد ( T = 293.15 K) و حداکثر رطوبت در این دما و فشار معمولی ( ρi . = 0.017 kg/m³)، فشار بخار محاسبه شده به این ترتیب حدود 23.39 hPa است
از آنجایی که فشار جزئی بخار آب تنها بخش کوچکی از فشار هوا را تشکیل میدهد، تعادل ترمودینامیکی تنها پس از یک دوره زمانی نسبتاً طولانی اتفاق میافتد، به این معنی که اشباعهای قابلتوجهی در اتمسفر زمین ممکن است بدون اینکه آب مایع موجود بلافاصله بجوشد. به همین دلیل و دینامیک بالا در اتمسفر، حالت های ترمودینامیکی پایدار معمولاً به ندرت یا فقط به طور مختصر، به ویژه در مناطق بسیار فعال جوی زمین در شرایط جوی مواجه می شوند. وجود داشته باشند که همزمان آب و یخ در ابر با توجه به فشار بخار نسبتاً محلی بالاتر بالای فاز مایع ، ذرات یخ به قیمت قطرات آب رشد میکنند .
جامد غیر فوق گرم فشار بخار بالای یک فاز کمتر از فاز مایع در همان دما است. اگر هر دو فاز از طریق گازهای اطراف آنها با یکدیگر در تماس باشند، نسبت جامد به قیمت مایع افزایش می یابد . دلیل این امر این است که اتصال قویتر ذرات در جامد و آنتالپی همجوشی حاصل در حالت تصعید ، یعنی انتقال فاز از جامد به گاز نیز باید غلبه یا اعمال شود. ذرات در فاز مایع آسانتر و در نتیجه بیشتر در نتیجه، تبخیر یا تبخیر از تصعید ذرات در بالای فاز جامد است. بنابراین ذرات در حالت گازی بالای مایع بیش از جامد هستند که فشار بخار را به صورت موضعی افزایش میدهد و منجر به رشد فاز جامد میشود.



